|
|
一、蛋白质组学
1.1 从基因组到蛋白质组
1949年,Francis Crick提出20世纪生命科学领域最重要的发现之一——“中心法则”。随着研究的深入,人们逐渐认识到生命体是一个复杂的系统,仅研究单个生物大分子无法了解生命过程和疾病的发生机理,只有系统性地研究才能更深入理解生命现象。因此,组学的概念应运而生。
1986年,美国科学家Thomas Roderick首次提出基因组学概念。2003年“人类基因组计划”宣告完成。随着人类基因组测序的完成,以及科学家对生命科学的研究加深,越来越多的证据表明,基因组学信息并不能完整地阐释复杂疾病的发生与发展。由此,蛋白质组学、转录组学和代谢组学等如雨后春笋般蓬勃兴起。因为蛋白质处于中心法则下游,且是生命活动的最终执行者,其在生命及疾病发生发展过程中的意义丰满的寡妇,因此蛋白质组学作为其中最重要的研究领域之一,受到广泛关注。
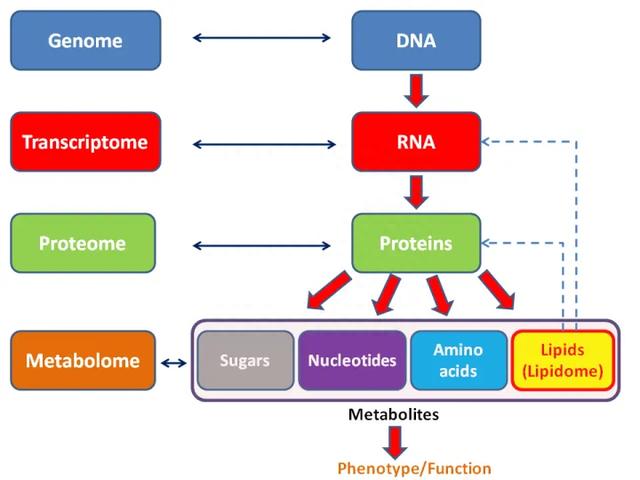
图1 基因组、转录组、蛋白组、代谢组之间关系的模式图。(图片来源:Wikipedia)
1.2 蛋白质组学的基本概念
蛋白质组(Proteome)一词最早是由澳大利亚科学家Wilkins和Williams于1994年提出,指的是一个细胞或组织中由基因组表达的全部蛋白质。而蛋白质组学(Proteomics)表示对整个蛋白质组的研究,是一门大规模、高通量、系统化的研究某一类型细胞组织、某一基因组所表达的所有蛋白质,包括组成蛋白质一级结构的氨基酸序列,蛋白质的丰度,蛋白质的修饰以及蛋白质之间的相互作用的学科。
1.3 研究蛋白质组学的重要性
虽然基因决定蛋白质的水平,但mRNA只包含了转录水平的调控,其表达水平并不能代表细胞内活性蛋白的水平,且转录水平的分析不能反应翻译后对蛋白质的功能和活性起至关重要作用的蛋白修饰过程,如酰基化、泛素化、磷酸化或糖基化等。而蛋白质组学除了能够提供定量的数据以外,还能提供包括蛋白定位和修饰的定性信息。只有通过对生命过程中蛋白质功能和蛋白质之间的相互作用以及特殊条件下的变化机制进行研究,才能对生命的复杂活动具有深入而又全面的认识。
1.4 蛋白质组学的分类
根据研究目的和手段的不同,蛋白质组学可以分为表达蛋白质组学、结构蛋白质组学和功能蛋白质组学。
表达蛋白质组学是指大规模研究分析鉴定细胞、亚细胞、组织、体液或生物体中所有的蛋白质及其表达水平。
结构蛋白质组学又称组成蛋白质组学,这是一种针对有基因组或转录组数据库的生物体或组织、细胞,建立其蛋白质或亚蛋白质组(或蛋白质表达谱)及其蛋白质组连锁群的一种全景式的蛋白组学研究,从而获得对有机体生命活动的全景式认识。
功能蛋白质组学以细胞内蛋白质的功能及其蛋白质之间的相互作用为研究目的,对选定的蛋白质组进行研究和描述,能够提供有关蛋白的糖基化、磷酸化,蛋白信号转导通路,疾病机制或蛋白-药物之间的相互作用的重要信息。
二、蛋白质组学的研究内容
利用蛋白质组学研究的内容主要包括:
1.蛋白质定性:鉴定特定细胞、组织或器官的蛋白质种类(蛋白质组全谱鉴定)。蛋白质组学的核心内容之一就是蛋白质鉴定。传统的方法如蛋白质微量测序、氨基酸组成分析(如Edman降解法)费时费力、通量低,存在不容易实现规模化和自动化,结果灵敏度差等问题。当前主流的基于软电离技术的液相色谱-质谱系统(Liquid Chromatography-Mass Spectrometry,LC-MS/MS)是实现高通量蛋白组全谱鉴定的主要方法。
2.蛋白质定量:研究特定条件下蛋白质的表达量变化(定量蛋白质组学)。例如在许多疾病的发生和发展进程中,常常伴随着某些蛋白质的表达异常。定量蛋白质组学就是把一个基因组表达的全部蛋白质或一个复杂的混合体系中所有的蛋白质进行精确的定量和鉴定。定量蛋白质组学技术主要分为标记(Label)和非标记(Label free)定量策略,标记策略又分为体内标记和体外标记两种。
3.蛋白质功能:明确蛋白质在生命活动中执行的功能(功能蛋白质组学),揭示蛋白质之间复杂的相互作用机制(相互作用蛋白质组学)。如分析酶活性和确定酶底物,细胞因子的生物分析/配体-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物——蛋白质的功能,另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。
4.蛋白质结构:研究蛋白质精确的二维、三维甚至四维结构(结构蛋白质组学)以及蛋白质翻译后修饰(修饰蛋白质组学)。通过理论研究计算推导预测蛋白质的空间结构,或者探索蛋白质在结构变化过程中各种光学、物理学等特征变化来了解蛋白质结构信息。利用液相色谱-质谱系统(LC-MS/MS)结合数据库检索的方法,实现对目前所有已知的修饰位点磷酸化,乙酰化,泛素化进行鉴定。对蛋白质结构的研究可以有助于深入理解其功能机制,也可以帮助进行药物筛选和设计思路优化。
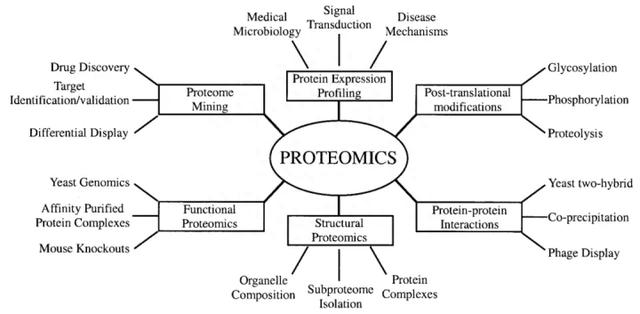
图2 蛋白质组学的类型及其在生物学中的应用(Graves et al., 2002)。
三、蛋白质组学的研究流程
现在目前常用的蛋白质组学研究的分析方法是基于液相色谱-质谱系统(LC-MS/MS)的Bottom-up/Shotgun分析,大致的流程可以分为:
1.样品制备:对组织或细胞进行提取分析得到蛋白。样品制备是蛋白质组学研究的第一步,直接影响到后期的研究结果。样品来源不同,制备的方法也有所不同,但都会遵循以下几个原则:①尽可能采用简单方法进行样品处理,以避免蛋白丢失;②细胞和组织样品的制备应尽可能减少蛋白的降解;③尽可能提高样品的溶解度;④防止加入人为修饰。
2.样品蛋白分离:通过蛋白酶将蛋白降解为肽段,并利用色谱对酶切后的肽段进行分离。双向凝胶电泳(2DE)是比较早发展的技术,根据等电点和分子量把蛋白在二维水平进行分析,但分辨率较低。高效液相色谱(HPLC)以经典的液相色谱法为基础,引入气相色谱法的理论与实验方法,流动相改为高压输送,采用高效固定相及在线监测等手段发展而成的分离方法,它可以单独使用,或者与质谱仪联用(HPLC-MSM),是目前蛋白质组学中样品分离的主流方法。
3.电离和质谱分析:将分离后的肽段加压使其离子化,进行质谱检测,收集信号,得到谱图。
4.蛋白鉴定:将质谱结果与数据库进行比对,鉴定出蛋白。
5.蛋白定量:根据技术分为标记定量(Label)和非标记定量(Label-free)。标记定量是通过不同化学试剂或同位素对相同肽段进行标记,从而在同一张质谱图中形成具有固定质量差的同位素峰,利用同位素峰从而对特定肽段进行定量分析。目前的技术包括iTRAQ、SILAC、SWATH、ICAT等,通过对一级图谱和二级图谱的分析对蛋白进行定量,具有灵敏度高、定量准确等特点。
非标记定量主要是基于离子流色谱峰(extracted ion current, XIC)的定量算法或谱图计数法(spectral counting, SC)进行蛋白峰度的相对定量。但是对液相色谱分离及串联质谱鉴定的清纯可爱美女性和重复性要求较高,需要有足够的技术重复以确保结果的可靠性。
6.数据分析:将筛选得到的差异蛋白,进行生物信息学分析,对蛋白质组学数据进行多角度的分析和挖掘。
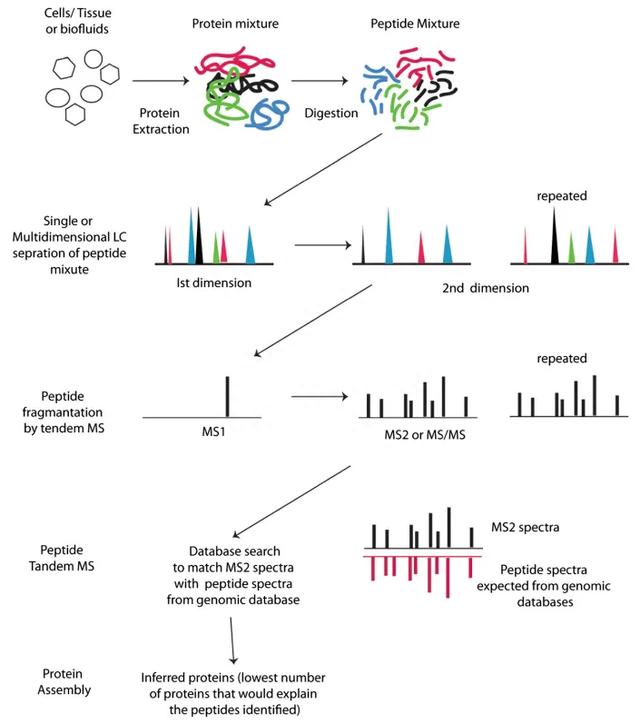
图3 Bottom-up/Shotgun蛋白质组学的分析流程(Bhargava et al., 2014)。
参考文献
Bhargava Maneesh, Higgins LeeAnn, Wendt Christine H, et al. Application of clinical proteomics in acute respiratory distress syndrome.[J]. Clinical and translational medicine, 2014,3(1).
Graves Paul R, Haystead Timothy A J. Molecular biologist's guide to proteomics.[J]. Microbiology and molecular biology reviews : MMBR, 2002,66(1). |
|